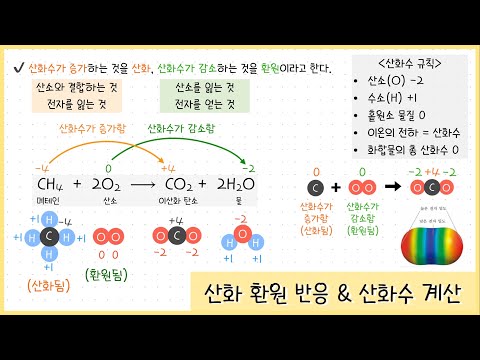
산화환원 반응이란 무엇일까요?
산화환원 반응(redox reaction)은 전자의 이동을 수반하는 화학 반응입니다. 한 물질이 전자를 잃는 과정(산화)과 다른 물질이 전자를 얻는 과정(환원)이 동시에 일어납니다. 산화와 환원은 항상 동시에 발생하며, 하나의 반응 없이는 다른 반응이 일어날 수 없습니다. 쉽게 말해, 전자를 잃는 쪽은 산화되고, 전자를 얻는 쪽은 환원됩니다. 일상생활에서도 녹스는 현상(철의 산화)이나 연소(물질의 산화) 등 다양한 현상이 산화환원 반응의 예시입니다.

산화와 환원의 정의와 예시는?
산화는 전자를 잃는 반응이고, 환원은 전자를 얻는 반응입니다. 예를 들어, 철이 녹스는 과정(4Fe + 3O₂ → 2Fe₂O₃)에서 철(Fe)은 전자를 잃고 산화되어 산화철(Fe₂O₃)이 됩니다. 동시에 산소(O₂)는 전자를 얻고 환원됩니다. 또 다른 예시로는 광합성 과정이 있습니다. 식물은 이산화탄소를 환원시켜 포도당을 생성하고, 물을 산화시켜 산소를 방출합니다.
| 반응물 | 산화/환원 | 전자 이동 | 생성물 |
|---|---|---|---|
| Fe | 산화 | 전자 잃음 | Fe³⁺ |
| O₂ | 환원 | 전자 얻음 | O²⁻ |
| CO₂ | 환원 | 전자 얻음 | C₆H₁₂O₆ |
| H₂O | 산화 | 전자 잃음 | O₂ |
전자 이동 기반 산화환원 반응 연구의 중요성은?
전자 이동 기반 산화환원 반응 연구는 다양한 분야에서 중요한 역할을 합니다. 에너지 생산(연료전지, 배터리), 환경 정화(오염물질 분해), 생체 내 대사 과정(호흡, 광합성) 등 산화환원 반응은 우리 생활과 밀접하게 연관되어 있습니다. 이러한 반응의 메커니즘을 이해하고 제어하는 것은 새로운 기술 개발과 환경 문제 해결에 필수적입니다. 특히, 효율적인 에너지 변환 기술 개발을 위해서는 산화환원 반응에 대한 깊이 있는 이해가 요구됩니다.
산화환원 반응의 실생활 적용 사례는 무엇일까요?
산화환원 반응은 우리 주변에서 흔히 볼 수 있는 현상입니다. 예를 들어, 배터리는 산화환원 반응을 이용하여 화학 에너지를 전기 에너지로 변환합니다. 또한, 연소는 산화환원 반응의 대표적인 예이며, 우리가 에너지를 얻는 주요 방법 중 하나입니다. 녹, 부패, 그리고 사진 현상도 모두 산화환원 반응의 결과입니다. 이러한 다양한 현상을 이해하는 것은 일상생활 속 문제 해결 및 기술 발전에 큰 도움이 됩니다.
산화환원 반응 연구의 미래 전망은 어떨까요?
산화환원 반응 연구는 지속 가능한 에너지 개발, 환경 오염 문제 해결, 생명 과학 분야 발전에 크게 기여할 것으로 예상됩니다. 고효율 연료전지, 차세대 배터리, 환경 친화적인 산업 공정 개발 등 다양한 분야에서 활용될 가능성이 높습니다. 특히 인공 광합성 기술 개발을 통한 지속가능한 에너지 생산은 미래 사회의 중요한 과제이며, 산화환원 반응 연구의 발전과 밀접한 관련이 있습니다.
함께 보면 좋은 정보: 산화수와 반쪽 반응
산화수는 원자가 전자를 잃거나 얻었다고 가정했을 때의 원자의 가상적인 전하를 나타냅니다. 산화환원 반응에서 산화수의 변화를 통해 산화와 환원을 판별할 수 있습니다. 반쪽 반응(반쪽셀 반응)은 산화 반응과 환원 반응을 각각 따로 나타낸 것입니다. 산화 반응과 환원 반응은 항상 짝을 이루지만, 반쪽 반응으로 나누어 분석하면 반응 메커니즘을 더 잘 이해할 수 있습니다. 산화수와 반쪽 반응에 대한 이해는 산화환원 반응을 더욱 심도 있게 이해하는 데 도움을 줍니다.
산화환원 반응 심화 가이드: 전자 이동의 심층 분석
산화환원 반응의 종류에는 무엇이 있을까요?
산화환원 반응은 다양한 형태로 나타날 수 있습니다. 단순한 전자 이동 반응부터 복잡한 다단계 반응까지, 그 종류는 매우 다양합니다. 대표적인 예로는 단일 전자 이동 반응, 다중 전자 이동 반응, 그리고 촉매가 관여하는 반응 등이 있습니다. 각 반응의 특징과 메커니즘을 이해하는 것은 산화환원 반응의 전반적인 이해에 중요한 역할을 합니다.
산화환원 적정의 원리와 응용은?

산화환원 적정은 산화제 또는 환원제의 표준 용액을 사용하여 미지 시료의 농도를 정량적으로 분석하는 방법입니다. 산화환원 지시약 또는 전위차 적정법을 이용하여 종말점을 확인합니다. 산화환원 적정은 환경 분석, 식품 분석, 의약품 분석 등 다양한 분야에서 널리 활용됩니다. 정확한 분석을 위해서는 적정 과정과 종말점 판정에 대한 정확한 이해가 필수적입니다.
전기화학적 산화환원 반응: 전극 반응과 전지
전기화학은 전기 에너지와 화학 에너지의 상호 변환에 관한 학문입니다. 전기화학적 산화환원 반응은 전극에서 일어나는 산화 또는 환원 반응을 이용하여 전기를 생산하거나 화학 반응을 유도하는 기술입니다. 전지는 전기화학적 산화환원 반응을 이용한 대표적인 예시로, 다양한 종류의 전지가 개발되어 사용되고 있습니다. 전지의 성능 향상을 위한 연구는 지속적으로 이루어지고 있습니다.
산화환원 반응과 촉매의 역할은?
많은 산화환원 반응은 촉매의 도움을 받아 진행됩니다. 촉매는 반응 속도를 증가시키지만, 반응 자체에는 참여하지 않습니다. 산화환원 반응에서 촉매는 반응 중간체를 형성하여 활성화 에너지를 낮추거나, 반응 경로를 변화시킴으로써 반응 속도를 증가시킵니다. 산화환원 촉매는 다양한 산업 공정에서 중요한 역할을 수행합니다.
산화환원 반응과 생체 시스템: 호흡과 광합성
생체 시스템에서 산화환원 반응은 에너지 생산과 물질 대사에 필수적인 역할을 합니다. 호흡 과정은 유기물의 산화를 통해 에너지를 얻는 과정이며, 광합성은 빛 에너지를 이용하여 이산화탄소를 환원시켜 유기물을 생성하는 과정입니다. 이러한 생체 내 산화환원 반응은 효소의 촉매 작용을 통해 매우 효율적으로 진행됩니다.
함께 보면 좋은 정보: 전기화학적 셀과 Nernst 방정식
전기화학적 셀은 산화 반응과 환원 반응이 분리된 두 개의 전극으로 구성됩니다. 이러한 셀에서 발생하는 전위차는 Nernst 방정식을 이용하여 계산할 수 있습니다. Nernst 방정식은 전극 전위와 반응물의 농도 간의 관계를 나타내는 식으로, 전기화학적 산화환원 반응을 이해하는 데 중요한 역할을 합니다. 전기화학적 셀과 Nernst 방정식에 대한 이해는 산화환원 반응의 전기화학적 측면을 심도 있게 이해하는 데 도움을 줍니다.